A nem-strukturális fehérjék funkcióinak áttekintése
2014.03.28. 16:01
Az úgynevezett nem-strukturális fehérjék csoportjába a picornavírus genom P2 és P3 régióján (lásd ”A picornavírus genom felépítése” bejegyzést) valamint egyes vírusoknál a P1 régió előtti szakaszon (Leader fehérje kódoló szakasz) kódolt virális fehérjék tartoznak. A csoportot különböző (olykor összetett) funkcióval rendelkező fehérjék alkotják. Ebben a részben megpróbálom röviden áttekinteni az egyes ismert nem-strukturális fehérjék funkcióit, az esetleges funkciók nagy száma miatt a teljesség igénye nélkül. Az egyes fehérjéket a vírus genomon található elhelyezkedésük (lásd a bejegyzés ábráját) sorrendjében tárgyalom.
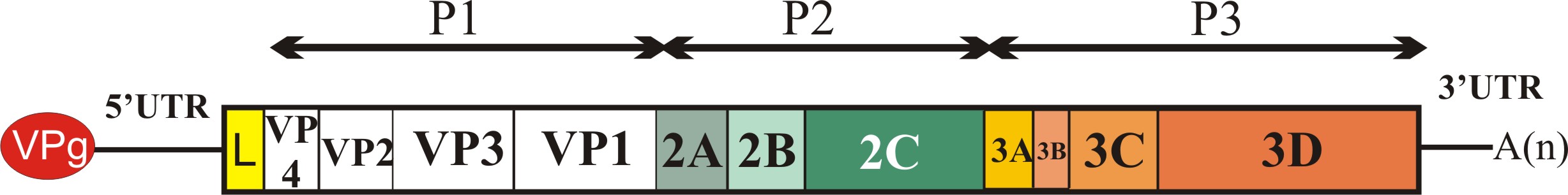
Leader
Minden olyan fehérjét Leader-nek neveznek, amely a picornavírus genom P1 régiója (kapszid-fehérjék) előtti részen kódolódik függetlenül attól, hogy az milyen funkcióval rendelkezik. Az eddig ismert emlős picornavírusok több mint fele kódol valamilyen Leader fehérjét. Az egyes Leader fehérjék mérete nagyon változékony, az egészen rövidtől (pár tíz aminosav) akár 462 aminosav hosszúságig változhat. Az eddig azonosított Leader fehérjék jelentős részéről nem tudjuk, hogy milyen funkciót lát el a vírus replikációjában. Az FMDV (papain-szerű cisztein proteáz) és a cardiovírusok (Zn-kötő fehérje) Leader fehérjéi szerepet játszanak a virális poliprotein érési folyamataiban, a gazdasejt CAP-függő transzlációjának leállításában, valamint a gazdaszervezet immunfolyamatainak kijátszásában.
2A
A virális kapszid fehérjéket (VP4, VP2, VP3 és VP1) kódoló régió (P1) után funkcionális szempontból igen változatos fehérjéket kódoló régiót találunk. A 2A régió az ismert emlős picornavírusok egy kis részében (pl. Ljungan vírus, Pasivirus, vagy a tengeri emlősöket fertőző aquamavírusok) nem egy, hanem két fehérjét (2A1 és 2A2) kódol (ún. dicisztronos 2A régió), azonban az emlős picornavírusok döntő többségében csak egy fehérjét kódoló, ún. monocisztronos 2A genom régiót találunk.
Jelen ismereteink szerint összesen 4 különböző 2A típust ismerünk:
tripszin-proteáz funkciójú 2A (pl. az Enterovírus és valószínűleg a Sapelovírus nemzetségekbe tartozó picornavírusokban), amely képes saját magát leválasztani a virális poliproteinről, emellett több, a gazdasejt sejtplazmájában előforduló, a gazdasejt ún. CAP-függő fehérjeszintéziséhez nélkülözhetetlen transzlációs faktorokat (pl. eIF-4G) is képes elbontani.
Aphthovírus-szerű 2A fehérjék változatos hosszúságúak (20 - 145 aminosav) és valószínűleg változatos funkcióval is rendelkeznek. Ilyen típusú 2A fehérjét találunk egyes emlős picornavírusok, mint például az Aphthovirus, Cardiovirus, Erbovirus, Teschovirus, és Senecavirus nemzetség tagjai között.Ebbe a csoportba tartozó 2A fehérjék mindegyike ugyanarra a konzervatív aminosav-motívumra (DxExNPGP, ahol x bármilyen aminosav lehet) végződik. Ezt az aminosav-motívumot ”riboszóma-ugró” motívumnak is nevezik. A virális genom transzlációja során, a genomon végighaladó riboszómák (80S) elérik a DxExNPG↓P (↓: a ”hasadási helyet” jelöli) motívumot akkor a motívum utolsó két aminosava (G és P) között nem alakítanak ki peptidkötést, ami következtében az NPG-re végződő virális polipeptid darab leválik a riboszómáról, miközben a riboszóma folytatja a genom hátralevő részéről a fehérje szintézist. Emellett egyes aphthovírus-szerű 2A fehérjék (pl. cardiovírusok) szintén részt vesznek a gazdasejt CAP-függő fehérjeszintézisének leállításában.
Hepatitisz A-szerű 2A fehérjét egyelőre csak a Hepatitis A vírusokban írtak le. A 2A fehérjének nincs ismert, az előző két fehérjéhez hasonló fehérje-hasító funkciója. A 2A egy része a VP1 kapszid fehérjékhez kötötten (pX) jelenik meg a virion felszínén, szerepe lehet a virionok gazdasejt-membránnal történő beburkolódásának folyamatában (További olvasmány a témában itt)
Hbox-NC 2A fehérjék szintén elterjedtek az emlős picornavírusok körében. Ilyen típusú 2A fehérjét kódolnak az Aquamavirus, Kobuvirus, Parechovirus, és ”Rosavirus” nemzetség tagjai. A csoport 2A fehérjéi jelentős szerkezeti és szekvencia-rokonságot mutatnak az eukarióta H-rev107 fehérjékkel, melyek fontos sejt-proliferáció szabályozó szereppel rendelkeznek.
2B
A picornavírusok 2B proteinjeinek mérete viszonylag tág határok között mozog: 98 aminosav (rhinovírusok) és 283 aminosav (Equine rhinitis B virus). A 2C virális peptiddel alkotott fúziós fehérje (2BC) részeként részt vesz sejtmembrán-vezikulák kialakításában, amelyen picornavírus RNS genom replikációja zajlik. Az enterovírusok szabad 2B fehérjéi membrán-pórusokat formálhatnak a sejt Golgi apparátus, illetve endoplazmatikus retikulum membránjain, azonban ez az úgynevezett viroporin-funkció más picornavírusoknál (pl. aphtho-, cardio-, vagy hepatovirusoknál) nem azonosítható. A 2B fehérje funkciója a legtöbb picornavírusnál jelenleg ismeretlen.
2Chel
A 2C egy multifunkcionális vírusfehérje, amelynek szerepe van többek közt a vírus replikációjában illetve sejtmembrán-vezikulák kialakításában. Minden eddig ismert 2C fehérje rendelkezik egy ATP-kötő/bontó doménnel, ami az ún. III. helikáz szupercsaládba (HELSF3) tartozik. Hasonló HELSF3 doménnel rendelkező virális enzimek igen elterjedtek a vírusok világában. A 2C fehérjék vége általában egy amfipatikus szakaszt tartalmaz, amelynek szerepe lehet a 2C membránhoz kötődésében.
3A
Hasonlóan a 2B fehérjékhez a 3A peptidek mérete is igen változó: 76 (rhinovírus) és 150 (FMDV) aminosav között változhat. FMDV esetében a 3A hossza, a vírus fertőzőképessége és gazdafaj-spektruma között szoros kapcsolat áll fent. 3A-nak illetve 3B-vel alkotott fúziós fehérjének (3AB) fontos szerepe van a virális genomról történő fehérjeszintézis megindításában, illetve a 3D virális fehérje (lásd alább) ko-faktoraként is funkcionálhat, azonban ezek a feltételezett funkciók nem teljesen elfogadottak. Egyes enterovirális 3B proteinek képesek az endoplazmatikus retikulum és a Golgi apparátus közti fehérje-transzportot blokkolni. Azonban ez a 3B funkció sem univerzális a picornavírusok között.
3B
A 3B genom régió által kódolt rövid (21-23 aminosav) fehérje (VPg, 3BVPg) kovalensen kötődik minden ismert picornavírus RNS genomjának 5’ végéhez. A kötés kulcs aminosavja a VPg 3. tirozinja, ami minden ismert picornavírus VPg-ben azonos. A kisméretű VPg hidrofób részeket tartalmaz és erősen bázikus tulajdonságú aminosavakból áll. Egyes vírusnemzetségek tagjainál a VPg-kódoló 3B régió duplikált (mosavírusok, aquamavírusok) vagy akár triplikált (FMDV) formában is jelen lehet a vírusgenomon. A VPg fehérje védi a virális RNS-t a gazdasejt RNÁzaitól és fontos szerepe van a virális RNS genom negatív szálának szintézisében is.
3Cpro
A viszonylag nagyméretű (180-220 aminosav), cisztein-proteáz funkciójú 3C fehérje végzi el a virális poliprotein érési folyamata alatt lejátszódó hasításának dandárját. Emellett érett formában (3C) vagy 3D-vel alkotott fúziós fehérjeként (3CD) több gazdasejt sejtplazmájában előforduló fehérjék, transzkripciós és transzlációs faktorok inaktiválásáért is felelős. Ezáltal leállítja a gazdasejt transzkripciós és CAP-függő transzlációs folyamatait. Emellett minden ismert 3C fehérje rendelkezik egy erősen konzervatív RNS-kötő régióval is. A 3C-szerű cisztein proeteázok elterjedtek a pozitív egyszálú RNS vírusok körében is.
3DRdRp
A picornavírusok legkonzervatívabb fehérjéje a 3D, amely egy nagyméretű (460-470 aminosav) RNS-függő RNS polimeráz (RNA-dependent RNA polymerase, RdRp) funkciójú enzim. Ez a virális enzim képes mind a negatív, mind a pozitív RNS szál szintézisére a virális replikáció alatt. A 3D fehérje rokonságot mutat számos, replikáz funkciójú enzimmel, pl. DNS-, illetve RNS-függő DNS polimerázokkal.
Helyzetjelentés
2014.02.06. 10:52
Ahogy eddigi bejegyzéseimből láthatjátok, próbálom bemutatni azt a víruscsoportot amivel foglalkozom (picornavírusok), mivel a kutatásaim eredményeinek későbbi/folyamatos bemutatását megkönnyíti a víruscsoport ismerete. Mindemellett, mivel ez a blog alapjában véve egy kutatói napló, úgy érzem, illene beszámolnom arról is, hogy mit csinálok/csinálunk ebben az időszakban. Mint ahogy a bevezetőben említettem többek közt a madarak picornavírusaival (is) foglalkozom. Jelenleg gőzerővel próbálok egy előadás anyagot és hozzá egy tudományos posztert összerakni a 2014. március 9 és 13 között megrendezésre kerülő 18. Nemzetközi Picornavírus Találkozóra (EUROPIC2014). Az előadás címe, mint ahogy a mellékelt képen is láthatjátok 
(a képre kattintva a konferencia oldalára juthattok) ”Avian picornaviruses: detection, characterization and comparative genome analysis”. Egyébként a programot elnézve nagyon illusztris előadói társaságba kerültem, és egyúttal itt jegyezném meg, hogy tudomásom szerint egyetlen magyar előadóként fogom az országot (is) képviselni :). Az előadás egyébként a madarakból azonosított picornavírusok - szám szerint eddig 12 vírusfaj, amelyből kutatócsoportunk 5-öt (!) írt le - genomjainak elemzéséről, összehasonlításáról, lehetséges evolúciós utjainak feltárásáról szól majd. Mivel ezen a konferencián a szűk tudományterület (picornavírusok) legszakavatottabb művelői jelennek meg, az előadás felkészülési ideje igen hosszú időt vett/vesz el. Emellett zajlanak a további új (picorna)vírus genomok meghatározására irányuló a RT-PCR kísérletek, és természetesen a diagnosztikai vizsgálatok. Valamint jelenleg két, különböző madarakból azonosított új picornavírusok genetikai jellemzésén alapuló kéziratunk áll immáron több mint 6 hete elbírálás alatt. Ha esetleg elfogadják őket, akkor beszámolok a bennük foglaltakról :).
A strukturális fehérjék - a picornavírus virion általános felépítése
2014.02.06. 08:29
A picornavírusok a lipidburok nélküli (non-enveloped) vírusok csoportjába tartoznak. A virális lipidburokról részletes leírást itt találtok. A vírus örökítőanyagát (ami jelen esetben pozitív polaritású, egyszálú RNS, lásd 2014.01.17.-ei bejegyzést) 20-30 nm átmérőjű, általában 60 alegységből (kapszomerekből) felépülő fehérjeburok (kapszid) veszi körül. A picornavírusok virionjai általában ikozahedrális szimmetriájúak, ami gyakori más víruscsaládokba tartozó vírusok között is (pl: egyes növényi, rovar és baktériumok vírusai, lásd kép). További információkat az ikozahedrális virionok felépítéséről lásd a VIBERdb adatbázist.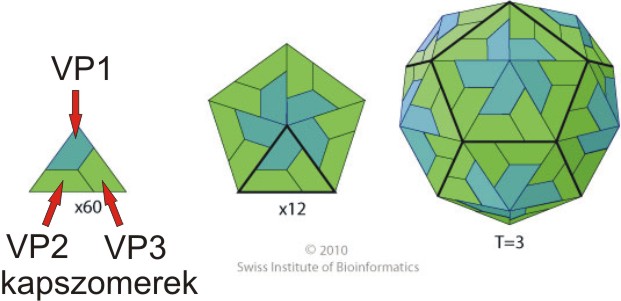
Elektronmikroszkópos felvételeken a picornavírusok vírusfajtól függetlenül általában sima felszínűek és gömb alakúak.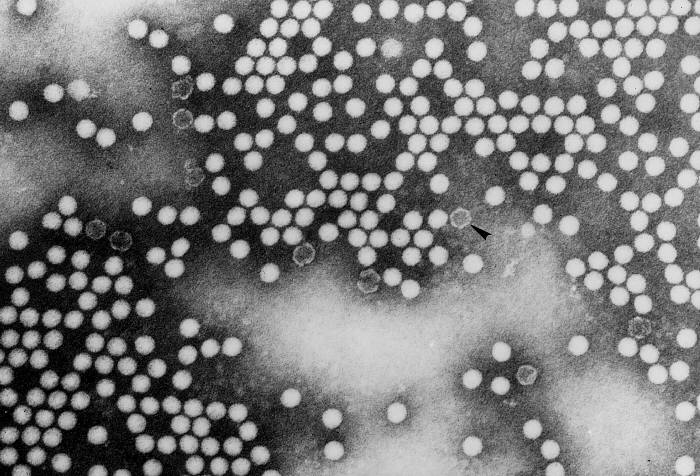
A picornavírus virion kapszidját általában 4 különböző kapszomer alkotja, név szerint: VP1-4 (más néven 1A-D), amelyeket a virális RNS genom P1 régiója kódol. Az eddig ismert picornavírusok közül a parechovírusok, a kobuvírusok valamint a teljesség igénye nélkül számos madár és hal picornavírus (lásd további bejegyzéseimet) kapszidját csak három kapszomer (VP0, VP3 és VP1) alkotja. A kapszomerek közül a VP1, 2 és 3 valamely része a virion felszínét alkotja, míg a VP4 (ha van) a kapszid belső felszínén található. Az egyes elektronmikroszkópos felvételeken látottakkal ellentétben a picornavírusok kapszidja molekuláris szinten nem sima felszínű, hanem például az enterovírusok esetében úgynevezett kanyonokkal szabdalt, azonban ez alól is vannak kivételek, pl. a száj-és körömfájást okozó picornavírus (foot-and-mouth disease virus - FMDV, Aphthovirus nemzetség) felszíne sokkal simább, kanyon-struktúráktól mentes.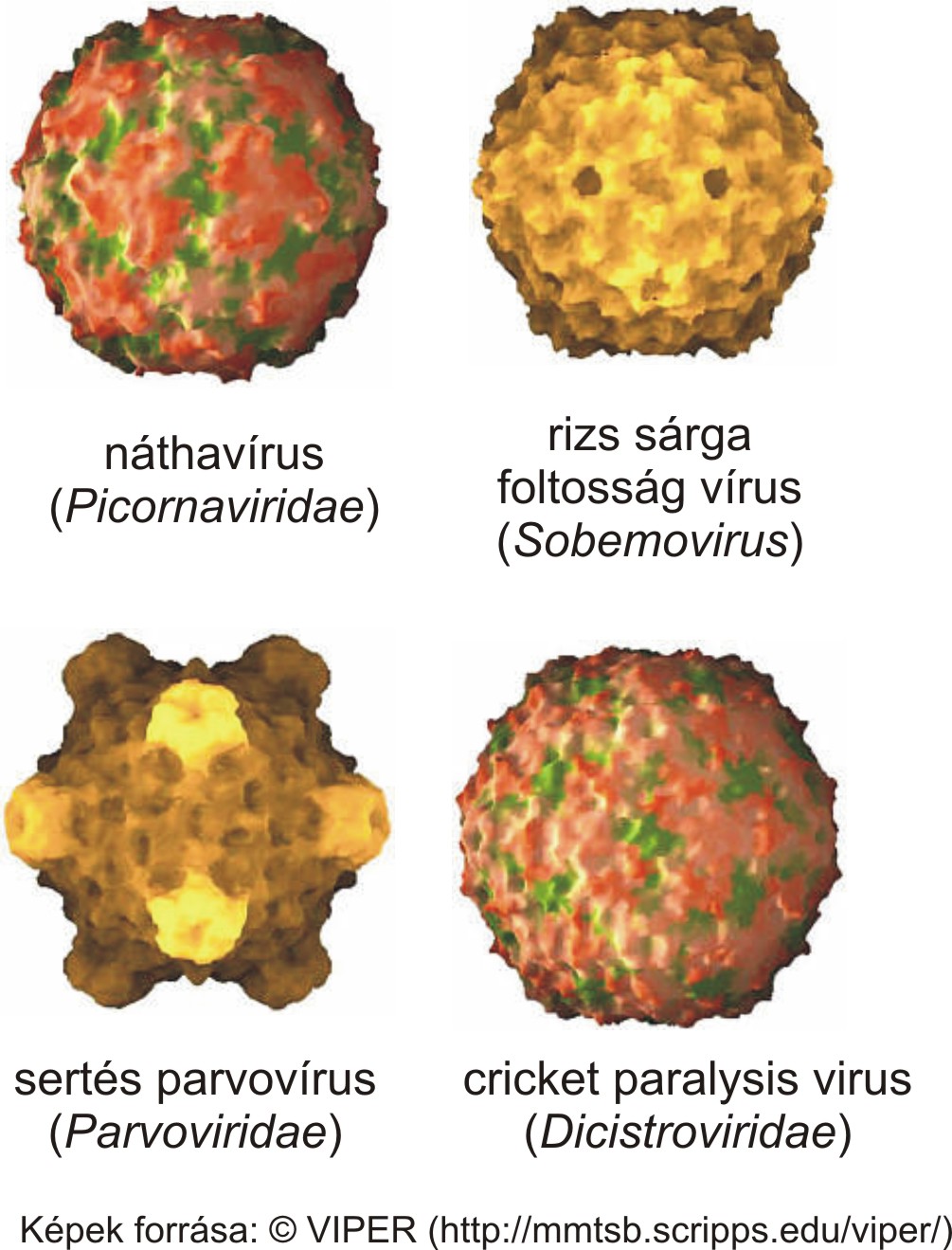
A kapszid feladata kettős, egyrészt óvja az egyébként nagyon sérülékeny RNS örökítőanyagot a külső környezet hatásaitól (kémiai anyagok, RNS-bontó enzimek…), másrészt fontos szerepe van a célsejthez történő kapcsolódásban (viral attachment) valamint a virion és ezzel együtt a virális örökítőanyag sejtplazmába juttatásában (virus entry). A célsejthez történő kapcsolódáshoz a kapszid fehérjék és a célsejt bizonyos sejtfelszíni fehérjéinek/receptorainak (pl. nátha vírusok esetében ICAM-1 vagy poliovírusoknál PVR) specifikus kapcsolódása szükséges. A kapszidot alkotó fehérjékkel lép kapcsolatba, és ezek ellen termel antitesteket a gazdafaj immunrendszere is. A sejtfelszíni receptorhoz történő kötődéshez a kapszomereken konzervatív (az egyes ”nemzedékek” között kevés változékonyságot mutató), míg a gazdaszervezet immunrendszerének kijátszásához változékony fehérjeszakaszokra van szükség. Általában a konzervatív fehérjeszakaszok a kanyon-struktúrák alsó részén, míg a változékony szakaszok a kanyonok csúcsi részén helyezkednek el. A kanyon-csúcsokat alkotó változékony fehérjeszakaszokat nevezzük a virion/vírus immunodomináns részeinek, amelyek az immunrendszer számára antigének, ezek a részek főleg a VP1 kapszomerek részét képezik. Általában a VP1 kapszomer aminosav-szekvencia különbségei képezik az alapját a picornavírusok különböző szerotípusokba történő szekvencia-alapú besorolását. Bővebben a szerotípusokról itt olvashattok. A különböző szerotípusokba tartozó vírusok ellen más-más antitestet termel az immunrendszer. Az egyik szerotípus ellen termelt antitestek nem, vagy csak kis mértékben hatásosak (ezt nevezik kereszt reakciónak) egy másik szerotípusba tartozó vírus ellen, ezért lehet az, hogy egy téli szezon alatt az ember akár többször is lehet náthás, mivel a náthavírusoknak (szintén picornavírus) jelenleg több mint 100 különböző szerotípusa ismert.
Források:
Chapter 26 - Picornaviridae. In: Fenner's Veterinary Virology 4th Ed.
Rossmann MG, He Y, Kuhn RJ. (2002).Picornavirus-receptor interactions. Trends Microbiol.10(7):324-31.
Pallansch, M., Roos, R., 2007. Enteroviruses. In: Knipe, D.M., Howley, P.M. (Eds.), Fields Virology. 5th ed. Lippincott Williams & Wilkins, Philadelphia, (Chapter 25), pp. 839–893.
A picornavírus genom felépítése
2014.01.17. 10:30
A gerinces fajokat fertőző Picornaviridae családba tartozó vírusok pozitív, egyszálú RNS (ribonukleinsav) genommal rendelkeznek. Az örökítő anyag típusára, és a genom megsokszorozódásának különbségeire épülő Baltimore vírus besorolási rendszer (lásd bővebben itt) IV csoportjába tartozik. Az eddig ismert ö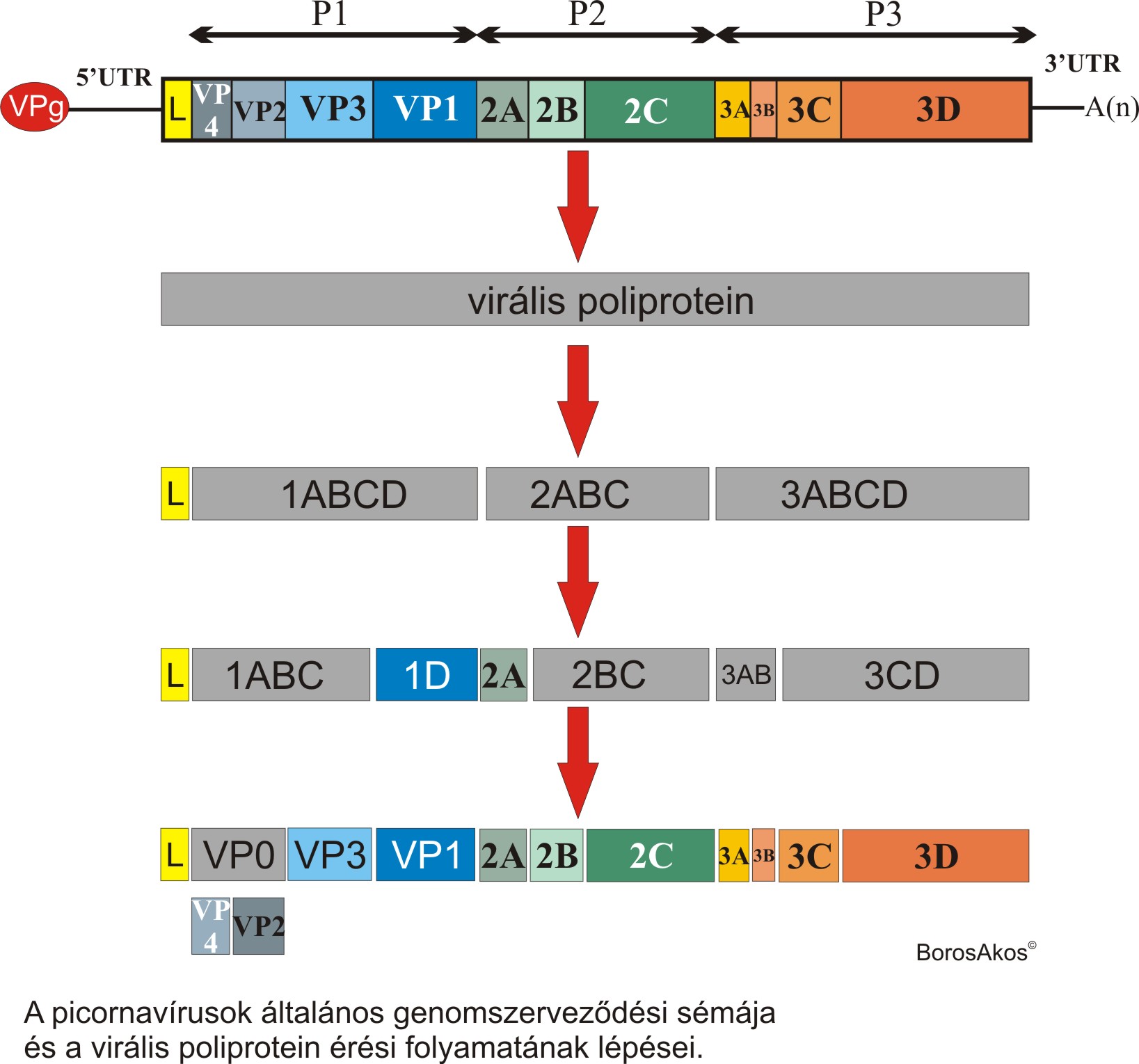 sszes picornavírus pozitív polaritású genomja változó hosszúságú poliadenin farokkal rendelkezik, amely genom felépítés nagyfokú hasonlóságot mutat az eukarióta hírvivő RNS (hírvivő = messenger, mRNS) molekulákhoz. A picornavírusok 7000-9000 ribonukleotidból álló genomja kevés kivételtől eltekintve egy nagyméretű virális poliproteint kódoló nyílt leolvasási keretből (Open Reading Frame = ORF) és az azt határoló 5’ és 3’ nem kódoló régióból (UnTranslated Region = UTR) áll. A genom 5’ végéhez egy a VPg nevű virális fehérje kapcsolódik. Az ORFről a megfertőződött sejtben átíródó, általában 240-250 kDa tömegű (2100-2800 aminosavból álló) virális poliprotein úgynevezett strukturális P1 (a virion fehérjeburkát alkotó fehérjéket kódoló) és nem-strukturális P2 és P3 (a vírus sejten belüli ciklusához köthető fehérjéket kódoló) részekre osztható. Virion = a sejtből kiszabadult, fertőzőképes vírus-partikula, fehérjeburok és genom együttese. A picornavírusok egy része egy úgynevezett ”Leader” (L) fehérjét is kódol, amely funkcióját tekintve a nem-strukturális fehérjékhez tartozik. A virális poliprotein specifikus - általában a virális poliprotein részét képező - fehérje bontó enzimek (3C, 2A; L) segítségével különböző méretű és funkciójú virális fehérjékre hasad. A hasadási folyamat köztes termékeit különböző betűkombinációkkal jelölik (pl.: 3CD a 3C és 3D virális enzimek prekurzora). A P1 régió a picornavírusok egy részében (pl.: parechovírusok, kobuvírusok…) VP0 (1AB), VP3 (1C), VP1 (1D) fehérjékre hasad, más picornavírusokban a VP0 fehérje hasításával további két fehérje (VP4 és VP2) jön létre.
sszes picornavírus pozitív polaritású genomja változó hosszúságú poliadenin farokkal rendelkezik, amely genom felépítés nagyfokú hasonlóságot mutat az eukarióta hírvivő RNS (hírvivő = messenger, mRNS) molekulákhoz. A picornavírusok 7000-9000 ribonukleotidból álló genomja kevés kivételtől eltekintve egy nagyméretű virális poliproteint kódoló nyílt leolvasási keretből (Open Reading Frame = ORF) és az azt határoló 5’ és 3’ nem kódoló régióból (UnTranslated Region = UTR) áll. A genom 5’ végéhez egy a VPg nevű virális fehérje kapcsolódik. Az ORFről a megfertőződött sejtben átíródó, általában 240-250 kDa tömegű (2100-2800 aminosavból álló) virális poliprotein úgynevezett strukturális P1 (a virion fehérjeburkát alkotó fehérjéket kódoló) és nem-strukturális P2 és P3 (a vírus sejten belüli ciklusához köthető fehérjéket kódoló) részekre osztható. Virion = a sejtből kiszabadult, fertőzőképes vírus-partikula, fehérjeburok és genom együttese. A picornavírusok egy része egy úgynevezett ”Leader” (L) fehérjét is kódol, amely funkcióját tekintve a nem-strukturális fehérjékhez tartozik. A virális poliprotein specifikus - általában a virális poliprotein részét képező - fehérje bontó enzimek (3C, 2A; L) segítségével különböző méretű és funkciójú virális fehérjékre hasad. A hasadási folyamat köztes termékeit különböző betűkombinációkkal jelölik (pl.: 3CD a 3C és 3D virális enzimek prekurzora). A P1 régió a picornavírusok egy részében (pl.: parechovírusok, kobuvírusok…) VP0 (1AB), VP3 (1C), VP1 (1D) fehérjékre hasad, más picornavírusokban a VP0 fehérje hasításával további két fehérje (VP4 és VP2) jön létre.
Bemutatkozás
2014.01.17. 10:18
A nevem BorosÁkos.
A BAMKH-NSZSZ-MLO Regionális Virológiai Laboratóriumának (Pécs) laboratóriumi biológusa vagyok. Munkám során járványügyi-diagnosztikai feladatok mellett új, pozitív egyszálú RNS vírusok azonosításával és molekuláris genetikai elemzésével foglalkozom. A pozitív egyszálú RNS vírusok csoportja a leg fajgazdagabb az eddig azonosított vírusok között, jelenleg 29 különböző víruscsalád (!) alkotja. A csoporton belül a Picornaviridae családba tartozó vírusok vizsgálatával foglalkozom. A picornavírusok között az ismert humán kórokozók (pl.: akut májgyulladást okozó Hepatitisz A, náthavírusok, járványos gyermekbénulást okozó poliovírusok) mellett, számos, haszonállatokra (köztük szárnyasokra) veszélyes, olykor gazdasági jelentőségű veszteségeket okozó vírusokat (száj- és körömfájást okozó vírus, enkefalomiokarditisz-vírus, Teschen betegséget okozó vírusok) is találunk. A TÁMOP 4.2.4.A/2-11-1-2012-0001 azonosító számú Nemzeti Kiválóság Program támogatásával jelenleg a vándorló, háziasított és ”városi” madarakban előforduló picornavírusok azonosításával, teljes genom-meghatározásával és jellemzésével foglalkozom. Jelen blog címe is a kutatási területemre utal ”Avian Virosphere” (Avirosphere). A kutatásaim hosszú távú célja a (picorna)vírusok közti törzsfejlődéstani/rokonsági kapcsolatok feltárása, amivel többek közt a jelenleginél jobb vírus-nevezéktani (taxonómiai) rendszert lehet kialakítani. Emellett, a (madarakból azonosítható) picornavírusok vizsgálata hozzájárulhat azon mikrobiológiai veszélyek felméréséhez, amelyek a vad madarak (köztük a vándormadarak és a ”városi” madarak) valamint az ember közvetlen érintkezésével felmerülhetnek.
A kutatás a TÁMOP 4.2.4.A/2-11-1-2012-0001 azonosító számú Nemzeti Kiválóság Program – Hazai hallgatói, illetve kutatói személyi támogatást biztosító rendszer kidolgozása és működtetése országos program című kiemelt projekt keretében zajlott. A projekt az Európai Unió támogatásával, az Európai Szociális Alap társfinanszírozásával valósul meg. 

